李碧优 ,马 洁,张启宇,章华兵,朱云平,
表皮干细胞(epidermal stem cells,EPSCs)主要位于表皮细胞的基底层。在皮肤创伤时,可从基底层迁移到创伤部位,促进伤口的修复和愈合[1]。EPSCs 随年龄增长逐渐减少,因此分离培养 EPSCs变得尤为重要,而人源 EPSCs 的分离和培养一直存在易污染、易分化的难点[2]。外泌体(exosomes, EVs)直径在30~150 nm的细胞外囊泡[3],干细胞是最常见的外泌体分泌细胞[4],相比干细胞,外泌体免疫原性低,内容物稳定易保存,以及易于量产等优点。外泌体的分离和提取一直是外泌体研究的难点[5]。
目前干细胞外泌体研究主要聚焦于间充质干细胞和脂肪干细胞,大都来源于大小鼠或细胞系[6],人源表皮干细胞外泌体(epidermal stem cells-exosomes,EPSCs-Exo)的研究甚少。该研究聚焦于体外分离培养人源 EPSCs,并探究EPSCs-Exo 体外分离纯化方法,为进一步研究人源 EPSCs-Exo生物学功能及作用机制提供实验基础,实现其临床治疗和转化。
1.1 组织来源皮肤组织来源于北京协和医院。经北京协和医院伦理委员会批准,伦理号:ZS-2556,本研究中共使用了 3 例男性患者的皮肤组织,年龄为 30~40岁,无其他疾病。患者本人知情同意,在进行包皮手术时,取多余的包皮组织用于分离EPSCs。
1.2 主要试剂Advanced DMEM/F12培养液、MEM非必需氨基酸溶液(NEAA,100×)、B-27无血清添加物(50×)、GlutaMAX(100×)、N-2羟乙基哌嗪-N-2-乙烷磺酸(HEPES, 1mol/L)、DispaseII酶、0.25%Trypsin/EDTA酶均购自Gibco公司。N-乙酰基-L-半胱氨酸(NAce,1 mmol/L)、TGFβ激活酶/激活素受体激酶抑制剂(A83-01)、人重组表皮生长因子(rhEGF)、wnt3a均购自Sigma-Aldrich公司。腺苷酸环化酶激活剂(Forskolin)购自Selleck公司,青霉素/链霉素(S/P,100×)、Matrigel胶购自Corning公司。兔抗人integrin-α6(货号:27189-1-AP)、integrin-β1(货号:12594-1-AP)、鼠抗人CD9(货号:60232-1)、兔抗人Calnexin(货号:10427-2)购自Proteintech公司,兔抗人Tsg101(货号:125011)、CK19(货号:ab52625)购自Abcam公司,兔抗人P63(货号:D2K8X-13109)购自Cell Signaling Technology公司,兔抗人CD63(货号:sc-5275)购自Santa Cruz公司,外泌体裂解液(货号:UR33101)购自Umibio公司。
1.3 主要仪器CO2培养箱、低温高速离心机、超高速低温离心机(美国,Thermo Scientific),电泳仪、半干转转膜仪(美国,Bio-Rad Laboratories),超灵敏多功能凝胶成像系统(瑞典,Cytiva),全电动倒置荧光显微镜(日本,Nikon),透射电子显微镜(美国,捷克Delong Instruments),纳米流式分析仪(中国,福流生物)。
1.4 人EPSCs的分离培养EPSCs改良2D培养液的配置:在无菌环境下,向100 ml的Advanced DMEM/F12培养液中分别加入1 ml NEAA、2 ml B-27、1 ml GlutaMAX、1 ml HEPES、25 μl wnt3a、1 ml NAce、20 μl hEGF、10 μl A83-01、10 μl Forsklin、1 ml 青霉素/链霉素(S/P)双抗配成培养液。
人包皮组织用含5×S/P、预冷的PBS缓冲液冲洗至无血污,剪去皮下的肌肉和脂肪,并切成1 cm2方块大小;
组织移至6孔板中,加入足量的Dispase II酶,37 ℃消化2 h,直至表皮和真皮轻松分离;
用镊子轻轻分离皮肤的表皮层和真皮层后,用含有5×S/P、预冷的PBS缓冲液分别进行清洗;
将分离的表皮放入新的6孔板中,加入适量的0.25%Trypin-EDTA,消化5~10 min,待有大量单细胞和细胞团出现时终止消化,防止细胞消化过度,影响存活状态。细胞悬液转移到离心管,1 000 r/min 离心5 min,弃上清液,加入预冷的PBS洗涤3次,40 μm无菌筛网过滤,再次离心,弃上清液。EPSCs培养液重悬细胞沉淀,轻轻吹打混匀,加入Matrigel基质胶包被的6孔板中,37 ℃ 细胞培养箱中培养。每天拍照观察,原代分离细胞首次2~3 d换液/次,待有较大的细胞克隆时改为1 d换液/次,以维持细胞生长所需要的营养。待细胞密度达到75% 左右进行传代。医院患者包皮样本通过物理剥离和改良的Tryspin-EDTA酶的化学消化法,成功分离出人的EPSCs。
1.5 人EPSCs的鉴定EPSCs 含有多种蛋白,如整合素、核蛋白 P63。糖蛋白和角蛋白目前已经作为 EPSCs 常见的标志物[7]。本研究采用integrin-α6、integrin-β1、P63和 CK19 作为 EPSCs 的标志物,分别采用免疫荧光染色和Western blot 进行鉴定。
1.5.1人 EPSCs 标志蛋白的免疫荧光染色鉴定 6孔板中EPSCs用4%多聚甲醛固定30 min,滴加10%正常山羊血清,室温封闭60 min;
滴加抗integrin-β1单抗、抗P63单抗、抗CK19单抗于湿盒4 ℃过夜,加入相应的荧光二抗,室温孵育1 h,DAPI染核后在荧光显微镜下观察并拍照。
1.5.2人EPSCs标志蛋白的 Western blot鉴定 EPSCs用0.25%Trypsin/EDTA 酶消化 3~5 min, EPSCs重悬至 10 ml 的离心管中,1 200 r/min 离心 5 min,弃上清液,取6孔板,按照150 μl/孔加入混合裂解液(RIPA裂解液 ∶PMSF=100 ∶1),吹打10~20次,冰上静置 30 min 后转入 1.5 ml EP管中,4 ℃、12 000 r/min 离心 15 min,取上清液,上清即目的蛋白,BCA法测蛋白浓度,配制 SDS-PAGE 凝胶行蛋白质电泳,将凝胶中的蛋白质转移至 PVDF 膜,5% 脱脂奶粉封闭,用 integrin-α6(1 ∶500)、P63(1 ∶500)、CK19(1 ∶500)、GAPDH(1 ∶1 000)的一抗 4℃ 抗孵育过夜,TBST 清洗 3 次.添加辣根过氧化物酶(HRP)标记的二抗(1 ∶5 000),室温孵育1 h,TBST 清洗 3 次,加 ECL 发光液进行化学发光成像,检测 integrin-α6、P63、CK19、GAPDH 的表达情况。
1.6 人EPSCs-Exo的分离与纯化6孔板中的 EPSCs 以1 ∶4传至 10 cm2的细胞培养皿中, 加入配置好的EPSCs培养液,待细胞密度至75%时,更换不含有因子的Advanced DMEM/F12的培养液,24 h收集细胞上清液,直至细胞边缘透明化,停止收集。收集的细胞上清液暂时放置于4 ℃,长时间放置于-80 ℃储存。收集P2-P5代的细胞上清液180 ml,4 ℃、1 348 r/min离心10 min,取上清液,3 692 r/min离心30 min,取上清液,4 ℃、33 028 r/min 离心2 h, 去除上清液,每管用5 ml预冷的PBS重悬,轻轻吹打重悬,再依次转移到32 ml预冷的离心管中,并用预冷的PBS将体积补足至30 ml。
4 ℃、3 328 r/min离心 2.5 h,离心后轻轻吸去上清液,用 50~150 μl 的 PBS 重悬,得到外泌体,放至-80 ℃保存。
1.7 人EPSCs-Exo 的鉴定国际细胞外囊泡学会(ISEV)在 2014 年提议,对于分离获得的外泌体需要从三个层面进行鉴定:① 透射电镜(transmission electron microscope,TEM)鉴定外泌体形态;
② 纳米颗粒示踪分析(nanoparticle tracking analysis, NTA)鉴定外泌体大小; ③ Western blot鉴定外泌体表面标志物[8]。国际囊泡学会在2018年进行了补充,对于鉴定外泌体表面标志蛋白,必须包含3个阳性蛋白和1个阴性蛋白对照,阳性蛋白位于外泌体膜上或者细胞内的蛋白,阴性蛋白表明分离的效率。在外泌体研究中,细胞膜蛋白CD63、CD9、CD81以及胞内Tsg101、Hsp70、Alix等是最常用的标志物[9-10]。本研究采用 Tsg101、CD9、CD63作为EPSCs-Exo的阳性标志物,Calnexin作为EPSCs-Exo的阴性标志物,采用Western blot进行鉴定,同时使用TEM和NTA法观测外泌体形态及大小。
1.7.1TEM下观察人EPSCs-Exo 采用 PBS 重悬提取的外泌体,滴于孔径 2 nm 的载样铜网上,室温静置 2 min,用滤纸从滤网侧边吸干液体,用3%磷钨酸溶液在室温下负染 5 min,滤纸吸干负染液,室温晾干,使用透射电镜观察拍照。
1.7.2NTA法检测人 EPSCs-Exo 将收集的外泌体颗粒通过光学显微镜收集其散射光信号及其在溶液中的布朗运动并进行拍照、追踪和分析,从而计算出外泌体粒径的大小和粒子的数目。
1.7.3Western blot法检测人 EPSCs-Exo 标志蛋白表达 分离得到的外泌体与外泌体专用裂解液(1 ∶1)冰上裂解 10 min,4 ℃、33 028 r/min离心 5 min,吸取上清液加上样缓冲液加热变性,配制 SDS-PAGE 凝胶行蛋白质电泳,将凝胶中的蛋白质转移至 PVDF 膜,5% 脱脂奶粉封闭,加入 Tsg101(1 ∶1 000)、CD9(1 ∶1 000)、CD63(1 ∶200)、Calnexin(1 ∶500)的一抗,4 ℃孵育过夜,TBST 清洗 3 次.添加辣根过氧化物酶(HRP)标记的二抗(1 ∶5 000),室温孵育 1 h,TBST 清洗 3 次,加ECL发光液进行化学发光成像,检测 Tsg101、CD9、CD63、Calnexin、GAPDH 的表达情况。
2.1 人皮肤组织分离EPSCs将用4%多聚甲醛固定 24 h 的 2 cm2大小的包皮组织用石蜡进行包埋,切成4 μm厚的切片,对石蜡切片进行免疫荧光染色,结果显示,核蛋白 P63、CK14、CK10 在皮肤组织中均表达阳性并呈分层状(图1)。核蛋白 P63 在皮肤组织具有增生潜能的基底层表达,表明细胞具有增生的潜能;
CK14 在组织的基底层表达,是短暂扩增细胞分化成EPSCs的阶段;
CK10 在皮肤组织表皮层表达,代表接近成熟的表皮细胞。通过皮肤组织染色进行 EPSCs 的组织溯源,显示了表皮细胞从干性到成熟,不断自我更新,从基底层、颗粒层、棘层、表皮层逐步迁移的过程,EPSCs可以来源于短暂扩增细胞或者分裂的 EPSCs,在空间上从基底层逐步分化成表皮细胞。

图1 人皮肤组织免疫荧光染色结果 ×10
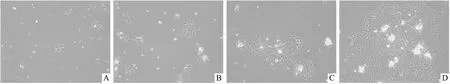
图2 细胞贴壁法分离培养的EPSCs形态学观察 ×10
2.2 人 EPSCs 的培养与鉴定
2.2.1人EPSCs的形态学观察 原代培养的人皮肤 EPSCs,在 matrigel 胶包被的板子上贴壁生长,当细胞密度到达75%进行传代,观察分离后不同天数的细胞生长状态。如图3所示,在第2天时,原代细胞贴壁生长(图2A),在第4~7天时,细胞逐渐形成克隆(图2B、2C),在第10天时,细胞克隆已生长成可以传代的密度,未分化的原代 EPSCs 排列整齐紧密,形态呈现规则的铺路石状,且细胞边缘光滑(图2D)。
2.2.2人EPSCs标志蛋白的鉴定 在细胞水平上,对P3代的EPSCs进行细胞免疫荧光染色,FITC荧光信号呈绿色,激发波长为488 nm, RFP荧光信号呈红色,激发波长为568 nm。对integrin-β1(ITGB1)、P63用绿色荧光标记,CK19用红色荧光标记,结果显示在EPSCs中高度表达EPSCs的标志分子integrin-β1和P63,中度表达CK19(图3A)。在蛋白水平上,将分离培养的EPSCs提取蛋白,对integrin-β1的同源标志物integrin-α6、P63、CK19和GAPDH进行Western blot分析,每组平行重复2个样本,结果显示EPSCs标志物integrin-α6、P63、CK19及GAPDH表达均呈阳性(图3B)。这些结果说明分离培养的EPSCs纯度较高,符合实验的要求,为外泌体的分泌奠定了基础。
2.3 人EPSCs-Exo的分离与纯化将 EPSCs从P2-P5代加入改良的EPSCs 2D培养液进行培养,待其密度达到50%~60%时收集细胞上清液,连续收集3~5 d,共收集400 ml的细胞上清液,对收集的细胞上清液进行低速和超速离心获得较纯的EPSCs-Exo。EPSCs的上清液通过优化的低速和超速离心法依次去除死细胞、细胞碎片和其他细胞杂质,最终获得高纯度的EPSCs-Exo。

图3 人EPSCs的鉴定
2.4 人EPSCs-Exo的鉴定通过TEM对EPSCs-Exo进行分析,结果显示,EPSCs-Exo具有非常明显的膜边界,呈大小不一的茶托或杯状结构(图4A)。NTA法检测结果表明,外泌体形态均匀,大小从80~150 nm,在127 nm处达到峰值,粒子数目为4.9E+9个(图4B)。对优化的低速和超速离心获得的EPSCs-Exo进行Western blot分析,结果显示Tsg101、CD9、CD63这三个外泌体表面标志物在EPSCs-Exo和EPSCs表达均呈阳性,且EPSCs-Exo的表达比EPSCs的表达稍强,Calnexin、GAPDH在EPSCs的表达中呈阳性,在EPSCs-Exo中表达呈阴性,符合国际细胞外囊泡学会对外泌体鉴定的要求,表明EPSCs-Exo分离纯度高(图4C)。以上结果表明本研究成功分离获得了纯度较高的人EPSCs-Exo。

图4 人EPSCs-Exo的特征鉴定
皮肤作为人体最大的器官,在防止外界病菌侵入、保持体温、防止水分蒸发、感受冷热痛等功能方面尤为重要[9]。EPSCs是皮肤中具有自我增殖和修复能力的干细胞,在烧伤、遗传性疾病引起的皮肤损伤等临床治疗研究中发挥了重要作用。本研究利用EPSCs慢周期性和自我增殖的特性[11],改良了EPSCs 2D培养液,通过添加各种可以滋养EPSCs、对抗其分化的营养因子,维持EPSCs分裂性和增殖性,延缓EPSCs分化和成熟,增加了EPSCs原代分离后的生存率,可以连续培养4代人源的EPSCs。不同于其他鼠源和细胞系来源的EPSCs,本研究选用临床患者的皮肤组织,运用细胞消化的方法,相比于组织培养法,细胞生长速度明显加快,细胞污染的概率降低,为临床提供了种子材料,有助于后续转化医学研究的开展。
不同干细胞分泌外泌体能力不同,目前尚未发表针对于人源EPSCs-Exo分离纯化的技术。根据现已发表的研究,笔者尝试参考脂肪干细胞和间充质干细胞外泌体的分离条件对EPSCs-Exo进行分离,发现低速离心次数太多、时间太长易导致EPSCs-Exo得率不高,且破坏其形态结构,无法获得纯度较高的EPSCs-Exo。因此笔者优化了差速离心条件:选用小转速、短时间的低速离心和大转速、长时间的超速离心法,成功获得了高纯度的人皮肤组织来源的EPSCs-Exo。
研究[4,12]表明,干细胞来源的外泌体可以有效转运mRNA、microRNA及蛋白质等生物活性物质,具有减少细胞凋亡、减轻炎症反应、促进血管生成、抑制纤维化、提高组织修复潜力等重要生物学功能,在调控组织再生方面存在良好的临床应用前景。相比于EPSCs,EPSCs-Exo易获取、无伦理审查的限制,可以穿过细胞膜到达细胞内发挥作用[13];
因此采用EPSCs-Exo代替EPSCs治疗皮肤损伤将成为下一阶段的研究热点。而目前外泌体治疗的技术难点在于外泌体分离和提取的难度大,纯度低,产量低,损耗大,结果不稳定[14]。本研究扩大细胞上清液的收集量,优化差速离心条件的方法,调整转速和超离时间,运用超速离心的方法,从而从细胞上清中稳定地提取到EPSCs-Exo。相比于PEG沉淀法、超滤、排阻等其他外泌体分离纯化的方法,超速离心法的纯度高,杂质少,为皮肤组织损伤修复提供了新的材料。
综上所述,本研究运用改良的Tryspin-EDTA酶从人皮肤组织中成功分离出EPSCs,添加 EPSCs改良的 2D培养液在体外进行培养,延缓人EPSCs分化,增加了EPSCs的生存率,刺激其持续分泌EPSCs-Exo;
通过优化超速离心的条件,高效高纯度提取人源EPSCs-Exo。
扩展阅读文章
推荐阅读文章
老骥秘书网 https://www.round-online.com
Copyright © 2002-2018 . 老骥秘书网 版权所有