宋 璐, 张舒阳, 王丽华, 左小磊, 李 敏
(1. 中国科学院上海应用物理研究所物理生物学实验室, 中国科学院界面物理与技术重点实验室,上海 201800;
2. 中国科学院大学, 北京 100049;
3. 上海交通大学医学院分子医学研究院, 上海市核酸化学与纳米医学重点实验室, 上海200127)
核酸检测是一种预防和诊断传染病的重要手段, 如广泛使用核酸检测来监测新型冠状病毒(SARS-CoV-2)的流行病学分布情况[1~3]. 此外, 基因过度表达、 表达不足以及基因突变与多种疾病相关[4~6]. SARS-CoV-2感染的临床急性时期, 在唾液和鼻咽拭子等临床样本中可检测到病毒RNA. 由于在感染SARS-CoV-2病毒的第4天左右病毒载量达到峰值, 在感染后的前5天内完成病毒RNA的检测是实现病毒检测的关键, 因此实现对大规模人群的及时检测需要高通量、 操作简单的检测技术. 目前,临床检验中的核酸检测大多数基于实时荧光定量PCR(Quantitative real-time PCR)技术, 然而传统实时荧光定量PCR需要严格控制样品制备的温度, 且存在技术复杂、 检测时间缓慢、 设备维护昂贵、 需要专业人员和检测通量较低等局限, 远不能满足高通量核酸检测的需求, 限制了分子生物学临床转化的发展[7~13].
2019年新冠疫情爆发以来, 核酸检测的需求量与日俱增[14]. 随着“15 min核酸采样圈”等常态化核酸检测措施的发布, 亟需建立完善、 高效运转的核酸检测系统. 为了提高检测效率, 核酸检测通常采用混采样本进行检测, 一个大型中心实验室的核酸检测日产能为10~15万管, 而对于千万级以上人口城市来说, 仍然不能满足核酸检测常态化的需求. 近年来, 高通量测序等技术的快速发展为高通量核酸检测提供了多种重要的技术平台[15~19]. 高通量测序一次可以实现对几十万条DNA分子的序列测定,凭借其高通量和测序快的优势可以提供丰富的核酸序列信息, 而且显著缩短了检测时间[20,21]. 目前,高通量测序已经成为组学研究的主要技术, 广泛用于基因组分析和转录组分析[22,23]. Koren课题组[24]从数千个单细胞的全基因组测序结果中分析DNA复制现象, 揭示了DNA复制起始时间的可变性;
Wrana课题组[25]从临床样本中提取RNA, 并进行高通量测序, 证实了高通量测序用于大规模监测SARS-CoV-2的可行性. 然而, 高通量测序用于核酸检测仍有很多问题需要解决:
测序数据量庞大导致储存和分析困难以及操作过程繁琐使其难以应用于临床诊断.
具有大规模、 高通量分析能力的生物检测微阵列芯片, 极大地促进了生物分析领域的发展. 制备高性能生物检测芯片的关键在于识别探针在生物芯片上的固定. 目前, 研究人员发展了表面修饰和生物分子固定化的策略, 用于制备高性能的生物检测微阵列芯片[26,27]. 然而, 这些研究仍然无法解决空间位阻、 静电相互作用和探针的空间排布等问题. DNA纳米技术能够自下而上地构建可控性好、 精密度高的DNA纳米结构, 已广泛应用于结构制造和传感领域[28]. 其中, 三维的、 具有正四面体结构的框架核酸由于具有较好的刚性和结构稳定性, 被广泛应用于界面上固定生物分子[29]. 该框架核酸结构可以将连接的探针以特定的方向固定在传感界面上, 从而以特定的方向捕获生物分子, 实现探针捕获效率的最大化.
本文构建了基于框架核酸(FNA)的探针, 发展了一种集成了超微量移液自动化平台和高通量基因芯片扫描仪的高通量生物微阵列检测芯片. 利用框架核酸在界面上对探针的调控能力, 预先将检测探针固定在框架核酸基底上, 利用超微量移液自动化平台对生物微阵列芯片进行编程, 从而驱动框架核酸探针在生物芯片上的高通量自动分配. 探针捕获核酸靶标后, 利用集成基因芯片扫描仪对该芯片进行成像, 每个包含不同浓度核酸靶标的生物芯片微阵列的荧光强度与靶标浓度具有较好的线性相关性, 而基于单链探针的生物芯片微阵列的荧光强度远低于框架核酸生物芯片微阵列. 因此构建的框架核酸高通量生物检测芯片能够简单、 准确和快速地实现对核酸靶标的高通量检测, 从而推动分子生物学临床转化的发展[30,31].
基因芯片点样液, 北京博奥生物有限公司;
实验所用其它试剂均购于生工生物工程(上海)股份有限公司. 框架核酸探针自组装溶液为 TM buffer[20 mmol/L Tris+50 mmol/L MgCl2, pH=8.0, 用Millipore系统的Milli-Q超纯水(18 MΩ·cm电阻)配制];
聚丙烯凝胶电泳缓冲液为1×TBE[购于生工生物工程(上海)股份有限公司, pH=7.4];
洗涤液为1×PBS[购于生工生物工程(上海)股份有限公司, pH=7.4]和PBST(1×PBS+体积分数0.5%的Tween20, pH=7.4);
封闭液为1×PBS与体积分数25%乙醇混合液配制的2.5 mg/mL NaBH4溶液, pH=7.4.
DNA链由生工生物工程(上海)股份有限公司合成, 序列如表1所示.

Table 1 Sequences of DNA
晶芯光学级醛基基片购于北京博奥生物有限公司;
Agilent Cary 100型紫外分光光度计(美国Agilent Technologies公司);
聚丙烯酰胺凝胶电泳仪(美国Bio-Rad公司, 041BR167315);
Amersham Imager 680型化学发光仪(美国CTL公司);
GE AKTA Pure型蛋白质层析纯化系统(美国通用电气医疗公司);
Nano-Plotter NP2.1型超微量移液自动化平台[仪智科技(上海)有限公司];
GenePix 4100A型微阵列基因芯片扫描仪(美国Molecular Devices公司).
1.2.1 框架核酸探针的设计、 合成及表征 参照文献[32]方法合成以框架核酸为基底的探针. 先用Q-H2O溶解粉末状DNA单链, 测定DNA单链在260 nm处的紫外吸收值;
利用Lambert-Beer定律, 将单链DNA浓度定量为100 μmol/L并置于4 ℃储存备用. 将合成框架核酸探针所需的4条DNA单链等比例混合, 用TM buffer配成终浓度为10 μmol/L的DNA单链混合溶液. 将混合溶液置于95 ℃ 10 min后, 迅速置于4 ℃降温20 min, 即可得到框架核酸探针纳米结构. 利用AKTA纯化系统, 对得到的纳米结构进行纯化得到框架核酸探针.
采用聚丙烯酰胺凝胶电泳(PAGE)验证结构的形成:
将制备的框架核酸纳米结构和单链、 两条链、三条链的杂交产物对照结构在8% PAGE中进行跑胶, 条件为85 V和1.5 h, 然后将凝胶在Gel-red水溶液中染色15 min, 最后用成像仪成像.
1.2.2 高通量生物检测芯片的制备 用超微量移液平台将框架核酸探针打印在生物芯片上进行成像.首先, 将15 μmol/L框架核酸探针用点样液稀释至10 μmol/L, 将混合液加在超微量移液平台的样品台上. 然后, 对超微量移液平台进行初始化处理, 并设定打印命令, 经过37 min的准备后, 超微量移液平台即可用于高通量打印框架核酸探针.
1.2.3 核酸靶标的高通量检测 检测芯片的处理流程如下:
将打印了探针微阵列的生物芯片在室温下置于70%湿盒中固定10 h, 用PBST洗涤液冲洗2次、 PBS洗涤液冲洗1次;
然后用封闭液在室温下封闭20 min, 使用PBST洗涤液冲洗2次、 PBS洗涤液冲洗1次. 将修饰有Cy3荧光团的不同浓度核酸靶标在室温下与探针孵育2 h, 再用PBST洗涤液冲洗2次、 PBS洗涤液冲洗1次后自然晾干, 在微阵列基因芯片扫描仪中进行成像. 使用微阵列基因芯片扫描仪和Image J软件对成像结果进行分析.
为了实现核酸靶标的高通量检测, 利用氨基和醛基的缩合反应在生物检测微阵列芯片上打印了框架核酸探针(图1). 将组成框架核酸探针的4条链按物质的量之比为1∶1混合、 退火, 形成了框架核酸探针. 首先, 采用聚丙烯酰胺凝胶电泳验证框架核酸结构的形成. 如图2所示, 框架核酸结构与其它几种未全部加入4条链的结构相比迁移速率较慢, 证明框架核酸探针已合成[33].

Fig.1 Schematic illustration of high-throughput microarray detection platform
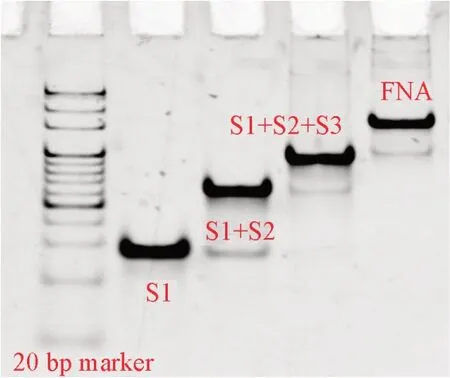
Fig.2 Formation of FNA probes
所设计的框架核酸探针能够通过碱基互补配对作用精准捕获靶标, 而探针的距离可以利用框架核酸结构在纳米尺度上精确调控[34]. 为了验证框架核酸探针在生物芯片上的高通量组装, 基于氨基与醛基基片的共价结合作用, 将框架核酸的3个顶点修饰氨基用于探针在芯片界面的固定, 另外1个顶点延伸的探针上修饰了Cy3荧光分子用于荧光测定. 如图3(A)所示, 超微量移液自动化平台将修饰了Cy3的框架核酸探针均匀打印在生物芯片上, 在一张75 mm×25 mm的芯片上打印了4800个点, 每个点的直径为270 μm. 因此可以实现4800种核酸靶标的同时检测, 远高于目前发展的基于链置换的ELISA高通量检测技术(96种核酸靶标)[35]和基于无机聚合物的液滴微阵列检测芯片(196种核酸靶标)[36]等技术.经统计, 打印100个点所用时间仅为55 s, 因此应用超微量移液自动化平台24 h即可打印157092个点[图3(B)]. 将此芯片用于核酸检测, 一台超微量移液自动化平台工作24 h检测通量与一间大型中心实验室的日检测通量相当, 而引入几台超微量移液自动化平台即可应对核酸检测更高通量的需求. 相比中心实验室的大型仪器, 超微量移液自动化平台进入工作状态前的流程也相对简单, 只需要37 min的准备时间[图3(C)].

Fig.3 Assembly of probes onto microarray platform
为了进一步规范化现行核酸检测工作, 国家卫生健康委员会对核酸检测的标本管理、 实验室检测等工作提出了新要求, 以保证检测质量、 提高检测效率. 其中, 要求检测临床样本前需对扩增试剂、 扩增仪等检测系统进行必要的性能验证, 包括精密度、 重现性及最低检测限等参数. 同样地, 为了将高通量核酸检测方法推广至临床应用, 对框架核酸探针、 超微量移液系统及高通量成像系统进行了性能验证. 在超微量移液系统中执行打印10×10点阵的命令, 将带有Cy3荧光团的框架核酸探针均匀打印在生物芯片上. 首先, 分析了该10×10点阵中每个点的平均荧光强度值, 如图4(A)所示, 这100个点的平均荧光强度值均约为300 a.u., 用式(1)计算出100个点平均荧光强度值的变异系数(CV, %)为3.30%, 远低于微阵列生物芯片点样仪技术要求的国家标准(CV≤10%).
式中:n为测定的点数;
i为测定的序号,i=1~n;
Xi为每个点的实测值;
为1~n次的算术平均数. 该结果说明超微量移液系统能够保证打印框架核酸探针的一致性. 接下来, 随机选取10个点, 分析其内部的荧光强度值[图4(B)], 在每个点内随机选取的5个区域的荧光强度值相近, 最大偏差仅为4.12%,说明尺寸均一的框架核酸能够调控探针在打印范围内均匀分布.

Fig.4 Performance of high-throughput nucleic acids detection platform
阵列规整度是衡量超微量移液系统性能的另一标准. 因此, 测量了相邻打印点中心位置的间距,图4(C)和(D)分别统计了100个点与相邻点的行、 列间距, 发现点阵内行、 列间距平均值为500 μm, 点间距离相对偏差W分别小于4%和10%, 同样满足微阵列生物芯片点样仪技术要求的国家标准(W≤10%). 以上结果说明, 此高通量核酸检测方法能够满足重现性的要求.
在生物芯片上组装框架核酸探针微阵列后, 评估了该生物芯片捕获核酸靶标的性能. 首先, 制备了2种微阵列, 使用单链探针和框架核酸探针分别与相同浓度的Cy3荧光团标记的核酸靶标进行杂交,荧光成像图如图5(A)所示, 发现基于框架核酸探针的微阵列显示出比单链探针微阵列更强的荧光信号. 定量结果表明, 其荧光强度值为单链探针微阵列的105倍[(7855.6±256.8) a.u.vs. (74.8±3.7) a.u.].这说明锚定在框架核酸顶点的探针特异性捕获靶标的数量是单链探针的105倍. 基于上述结果, 认为框架核酸在生物芯片上的高度有序排列, 使得锚定在其顶点的探针以间距均匀、 方向一致的状态排列在芯片微阵列中;
而线性的单链探针则以混乱的状态排布, 导致与靶标的杂交效率大大降低.
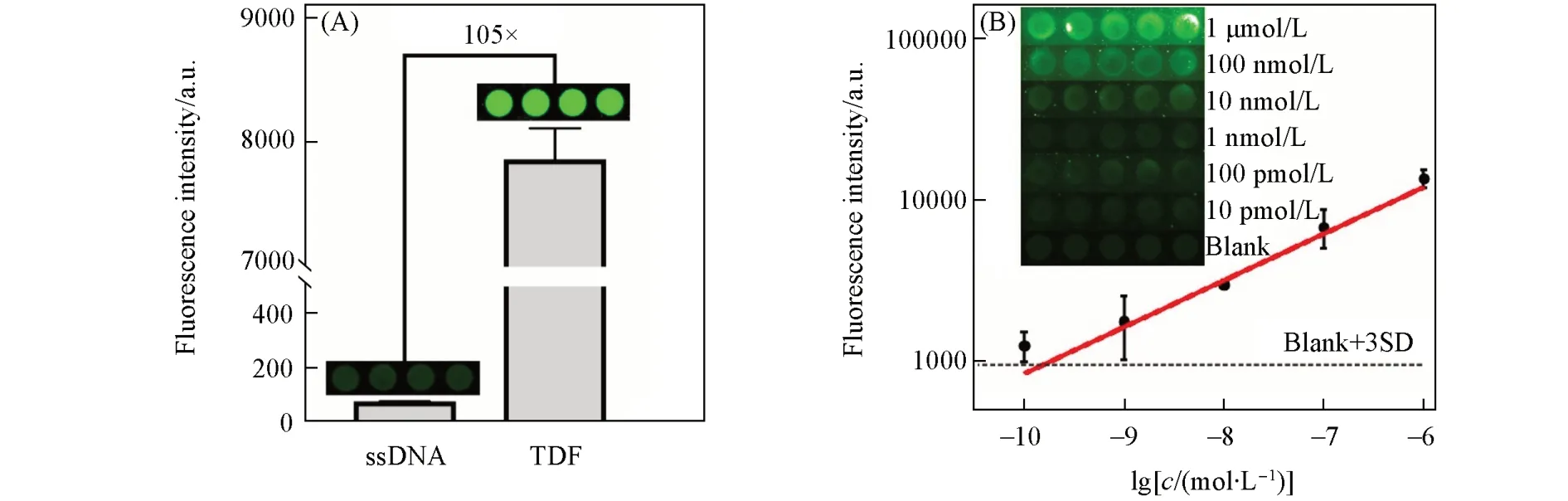
Fig.5 Performance of FNAs-based probe microarrays for targets sensing
随后, 检测了一系列不同浓度的靶标(10 pmol/L~1 μmol/L), 以评估框架核酸探针微阵列对核酸靶标的检测性能. 由图5(B)可见, 随着靶标浓度的增加, 荧光信号逐渐增加. 通过定量分析荧光信号值发现, 荧光强度值与靶标浓度具有良好的线性关系, 对数线性拟合方程为y=0.29x+(5.81±0.25),R2为0.982. 图中虚线表示Blank+3SD=911.66 a.u., 因此该框架核酸探针微阵列对核酸靶标的检出限为100 pmol/L. 空白基于框架核酸探针的生物微阵列检测芯片不仅具有较宽的动态检测范围, 而且可以识别低至100 pmol/L的核酸靶标.
基于框架核酸探针构建了一种具有自动均匀分配探针能力的高通量生物检测微阵列芯片, 该平台通过编程指令, 即可实现探针在生物芯片上的高通量自动分配. 这种基于框架核酸的高通量检测芯片可显著提高核酸检测的速度和效率, 芯片上点阵的间距(W≤10%)和荧光强度(CV=3.30%)具有较高稳定性, 能够满足当前核酸检测的常态化需求. 将该高通量检测芯片用于核酸靶标检测, 检出限低至100 pmol/L, 有望推动分子生物学临床转化的发展. 然而在实际临床应用中, 高通量微阵列检测芯片仍然具有一些局限性. 首先, 临床中不同个体的基因表达模式具有异质性, 这进一步增加了核酸检测的难度, 因此在应用微阵列检测芯片时要保证采样的一致性, 使采样过程标准化. 其次, 在芯片生产、 探针杂交和图像量化等过程中容易产生较大的差异性, 进而阻碍微阵列生物检测芯片临床转化的发展,因此需要发展标准化流程来减少各个流程中的不稳定因素.
猜你喜欢移液生物芯片靶标一种自动称重移液设备设计与实现电子制作(2022年13期)2022-08-02“百灵”一号超音速大机动靶标军民两用技术与产品(2021年10期)2021-03-16快速检测病毒生物芯片生物医学工程学进展(2020年2期)2020-01-07纳米除草剂和靶标生物的相互作用世界农药(2019年3期)2019-09-10你一直想知道的移液知识实验与分析(2018年3期)2019-01-04生物芯片信号处理与检测系统设计电子技术与软件工程(2016年24期)2017-02-23复杂场景中航天器靶标的快速识别光学精密工程(2016年4期)2016-11-07有关移液枪使用方法对移液准确性影响的讨论农产品加工(2016年16期)2016-09-27前列腺特异性膜抗原为靶标的放射免疫治疗进展肿瘤影像学(2015年3期)2015-12-09新型生物芯片在新加坡问世 可同时检测9大家禽疾病河南畜牧兽医(2015年13期)2015-08-15扩展阅读文章
推荐阅读文章
老骥秘书网 https://www.round-online.com
Copyright © 2002-2018 . 老骥秘书网 版权所有